MINIÜLEVAADE
Vähivastane eelpost: universaalsed ainult vähimarkerid
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Hiina;2 Harbini meditsiiniülikooli esimese sidushaigla üldkirurgia osakond, Harbin 150001, Hiina;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Hiina;4 Ningxia Hui autonoomse piirkonna rahvahaigla, Ningxia meditsiiniülikool, Yinchuan 750002, Hiina;5Shanghai rahvatervise kliiniline keskus ja üldkirurgia osakond, Huashani haigla ja vähi metastaaside instituut ja RNA epigeneetika labor, biomeditsiiniteaduste instituudid, Shanghai meditsiinikolledž, Fudani ülikool, Shanghai 200032, Hiina
ABSTRAKTNE
Vähk on maailmas peamine surmapõhjus.Vähi varajane avastamine võib vähendada kõigi vähitüüpide suremust;enamiku vähitüüpide puhul puuduvad tõhusad varajase avastamise biomarkerid.DNA metüülimine on alati olnud peamine huvipakkuv sihtmärk, kuna DNA metüülimine toimub tavaliselt enne teisi tuvastatavaid geneetilisi muutusi.Uurides vähi üldisi tunnuseid, kasutades DNA metüülimise jaoks uudset positsioneerimisjärjestust, on mitmed universaalsed ainult vähimarkerid (UCOM) kujunenud tugevateks kandidaatideks vähi tõhusaks ja täpseks varajaseks avastamiseks.Kuigi praeguste vähi biomarkerite kliinilist väärtust vähendab madal tundlikkus ja/või madal spetsiifilisus, tagavad UCOM-ide ainulaadsed omadused kliiniliselt olulised tulemused.UCOM-ide kliinilise potentsiaali kinnitamine kopsu-, emakakaela-, endomeetriumi- ja uroteelivähi korral toetab veelgi UCOM-ide kasutamist mitme vähitüübi ja erinevate kliiniliste stsenaariumide korral.Tegelikult on UCOM-i rakendusi praegu aktiivne uurimine koos vähi varajase avastamise, abidiagnostika, ravi efektiivsuse ja kordumise jälgimisega.Järgmised olulised teemad, mida tuleb uurida, on molekulaarsed mehhanismid, mille abil UCOM-id vähki tuvastavad.UCOM-ide rakendamine reaalsetes stsenaariumides nõuab samuti rakendamist ja täpsustamist.
MÄRKSÕNAD
Vähi avastamine;vähi sõeluuring;DNA metüülimine;vähi epigeneetika;vähi biomarkerid
Miks me vajame kiiresti uut biomarkerid?
Pärast üle sajandi kestnud võitlust vähiga on vähk endiselt inimkonnale kõige surmavam bioloogiline oht.Vähk on endiselt ülemaailmne terviseprobleem: 2020. aastal on hinnanguliselt 19,3 miljonit uut juhtumit ja peaaegu 10 miljonit surmajuhtumit1. 2020. aastal diagnoositi Hiinas hinnanguliselt 4,6 miljonit uut vähijuhtu, mis moodustab GLOBOCAN1 andmetel 23,7% uutest vähijuhtudest maailmas.Lisaks seostati Hiinas 2020. aastal vähiga umbes 3 miljonit surmajuhtumit, mis moodustas 30% ülemaailmsetest vähiga seotud surmajuhtumitest1.See statistika näitas, et Hiina on vähi esinemissageduse ja suremuse osas esikohal.Lisaks on 5-aastane vähi elulemus 40,5%, mis on 1,5 korda madalam kui USA 5-aastane elulemus2,3.Suhteliselt madalam elulemus ja kõrgem suremus Hiinas kui kõrgema inimarengu indeksiga riikides viitavad sellele, et kiiresti on vaja tõhusat ja kulutõhusat vähktõve ennetus- ja seiresüsteemi.Vähi varajane avastamine on tervishoiusüsteemi üks kriitilisemaid elemente.Vähi varajane avastamine võib parandada peaaegu kõigi vähitüüpide prognoosi ja ellujäämist varases staadiumis4.Edukad sõeluuringustrateegiad on toonud kaasa emakakaela-, rinna-, kolorektaalse ja eesnäärmevähi esinemissageduse ja suremuse olulise vähenemise.
Vähi varase avastamise saavutamine ei ole aga lihtne ülesanne.Varajase vähi bioloogia ja prognoosi uurimine, usaldusväärsete varajase avastamise biomarkerite tuvastamine ja valideerimine ning juurdepääsetavate ja täpsete varajase avastamise tehnoloogiate väljatöötamine on alati olnud protsessi suurimaks takistuseks4.Vähi täpne avastamine võib eristada healoomulisi kahjustusi pahaloomulistest, mis aitab vältida tarbetuid protseduure ja hõlbustab edasist haiguse juhtimist.Praegused varajase avastamise strateegiad hõlmavad endoskoobipõhiseid biopsiaid, meditsiinilist pildistamist, tsütoloogiat, immuunanalüüse ja biomarkeriteste5–7.Endoskoobipõhised biopsiad, mis on pealetükkivad ja kulukad, kannavad oma olemuselt suurt koormust suure meditsiinilise protseduurina, mis tugineb professionaalsetele töötajatele.Nagu tsütoloogia, sõltuvad mõlemad sõeluuringumeetodid meditsiinitöötajatest ja põhinevad isiklikul hinnangul ning tulemuslikkus pole kaugeltki ideaalne8.Seevastu immuunanalüüsid on kõrge valepositiivsete määrade tõttu väga ebatäpsed.Meditsiiniline pildistamine sõeluuringu taktikana nõuab kalleid seadmeid ja spetsialiseeritud tehnikuid.Seetõttu on meditsiiniline pildistamine vähese juurdepääsetavuse tõttu äärmiselt piiratud.Kõigil neil põhjustel näivad biomarkerid olevat parem valik vähi varajaseks avastamiseks.
Kirjavahetus: Yinshan Li ja Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 ja
https://orcid.org/0000-0001-9920-1133
Saabunud 22.08.2023;vastu võetud 12. oktoober 2023;
avaldatud veebis 28. novembril 2023.
Saadaval aadressil www.cancerbiomed.org
©2023 Vähibioloogia ja meditsiin.Creative Commons
Omistamine-mitteäriline 4.0 rahvusvaheline litsents
Biomarkerid liigitatakse praegu valkudeks, DNA mutatsioonimarkeriteks, epigeneetilisteks markeriteks, kromosomaalseteks kõrvalekalleteks, otseselt kasvajatest pärinevateks RNA-markeriteks või kehavedelikest kaudselt saadud kasvajafragmentideks.Valgumarkerid on vähi sõeluuringutes ja diagnoosimisel kõige laialdasemalt kasutatavad biomarkerid.Valgu biomarkereid kui sõeluuringu biomarkereid piirab healoomuliste kahjustuste kalduvus mõjutada, mis põhjustab ülediagnoosimist ja üleravi, nagu on teatatud α-fetoproteiini ja eesnäärmespetsiifilise antigeeni (PSA)9, 10 puhul.RNA markerite hulka kuuluvad geneetilised ekspressioonimustrid ja muud mittekodeerivad RNA markerid. Geneetilise ekspressiooni RNA markerite kombinatsiooni saab tuvastada uriiniproovide abil, mille tundlikkus ei olnud primaarsete kasvajate puhul kaugeltki rahuldav (60%) ja mille tuvastamine võib RNA kergesti lagunev iseloom normaalses keskkonnas11.Nii geneetilised kui ka epigeneetilised markerid seisavad silmitsi kasvajate levimuse ja vähitüüpidega piiramise probleemiga.
DNA metüülimine on olnud tugev kandidaat varajase avastamise biomarkerina alates sellest, kui Feinberg seostas selle esmakordselt vähiga 1983. aastal12. DNA metüülimise aberratsioone täheldatakse vähi kõikides staadiumides, juba vähieelses staadiumis.Aberrantne DNA hüpermetüleerimine toimub tavaliselt CpG saartel geenipromootorites, et neutraliseerida kasvaja supressoreid 13, 14.Uuringud on samuti näidanud, et ebanormaalne DNA hüpermetüleerimine on seotud arenguregulaatorite ülesreguleerimisega15.DNA metüülimise org, mida tavaliselt seostatakse arenguregulaatorite ja hüpermetüleeritud vähkidega, võib lülitada geeniekspressiooni režiimi stabiilsemale DNA metüülimisest sõltuvale režiimile ja vähendada seost metüleeritud histooni H3K27me3 ja sellega seotud polükombivalkudega 16, 17.
Paljude avaldatud DNA metüülimismarkerite hulgas on mitmed edukalt turul debüteerinud;Kuid praegused müügil olevad DNA metüülimismarkerid ja diagnostikapaneelid ei ole veel täielikult avanud vähi varajase avastamise potentsiaali mitmel põhjusel18.Kuigi need biomarkerid näitavad enamasti vastuvõetavat jõudlust andmebaasi teabe abil, toimivad need biomarkerid reaalses maailmas tavaliselt vähem ideaalselt, kuna reaalmaailma proovid on sageli keerukamad ega ole nii esinduslikud kui andmebaasides valitud.Järgmise põlvkonna sekveneerimisel põhineva mitme vähi metüülimise varajase avastamise tundlikkus on I ja II staadiumi vähi korral vastavalt vaid 16, 8% ja 40, 4% .Varajase avastamise testid nõuavad suuremat stabiilsust ja täpsemaid biomarkereid.
Universaalse vähimarkeri (UCOM) avastamine juhiste positsioneerimise järjestuse (GPS) abil
Vaatamata aastakümnete pikkusele vähiuuringutele ei ole rahuldavat ennetamist ja ravi saavutatud.Vaja on uusi metoodikaid, et teadlased saaksid vähki põhjalikult hinnata.Viimase 23 aasta jooksul on 6 vähi tunnust, nagu apoptoosist kõrvalehoidmine, kudede invasioon ja metastaasid jne, laiendatud 14-ni, hõlmates selliseid funktsioone nagu mittemutatsiooniline epigeneetiline ümberprogrammeerimine ja polümorfsed mikrobioomid20, 21.Kuna vähiga seotud üksikasju avalikustatakse, tuuakse vähiuuringutesse rohkem perspektiive.Vähiuuringud on järk-järgult jõudnud uuemasse ajajärku kahes suunas (ühisus ja individuaalsus).Täppisonkoloogia viimastel aastatel arenedes on vähiuuringute fookus kaldunud individualiseeritud sihtravile ja vähi heterogeensusele22.Seega on hiljuti tuvastatud vähi biomarkerid keskendunud peamiselt konkreetsetele vähitüüpidele, nagu PAX6 emakakaelavähk23 ja BMP3 kolorektaalse vähi puhul24.Nende vähitüüpidele spetsiifiliste biomarkerite jõudlus on erinev, kuid bioloogiliste proovide võtmise piiratuse ja kõrge hinna tõttu ei ole vastuvõtlikel inimestel võimalik üheaegselt läbida kõigi vähivormide sõeluuringut.Oleks ideaalne, kui suudaksime tuvastada ühe tugeva biomarkeri, mis on efektiivne kõigi vähivormide puhul varases staadiumis.
Sellise ideaalse eesmärgi saavutamiseks tuleb potentsiaalsete biomarkeritüüpide loendist valida parem biomarkeri kandidaat.DNA metüülimise aberratsioonid kõigi geneetiliste ja epigeneetiliste profiilide hulgas on teadaolevalt seotud vähiga ja on ühed varasemad, kui mitte esimesed, vähiga seotud kõrvalekalded, mis kronoloogiliselt ilmnevad.DNA metüülimise uurimine algas varakult, kuid seda on takistanud uurimismeetodite puudumine.Genoomi 28 miljoni potentsiaalse metüülitud CpG saidi hulgast tuleb tuumorigeneesi paremaks mõistmiseks tuvastada ja genoomiga joondada juhitav arv.Terve genoomi bisulfitjärjestus (WGBS), mida peetakse DNA metüülimise sekveneerimise kuldstandardiks, suudab vähirakkudes katta vaid 50% Cs-st, kuna bisulfitravi lõhub DNA fragmente ja vähendab genoomi keerukust. Cs-de muundumine Ts25-ks.Muud meetodid, nagu 450k kiibid, katavad ainult 1,6% genoomi metüülimisest.450 000 andmete põhjal on DNA metüülimise tuvastamise paneelil 35, 4% tundlikkus 6 tüüpi I staadiumi vähi puhul26.Vähitüüpide piirangud, kehv jõudlus ja avastamismeetodite tekitatud müra analüütilises protsessis on muutunud vähi tuvastamise paneelide suurimaks takistuseks.
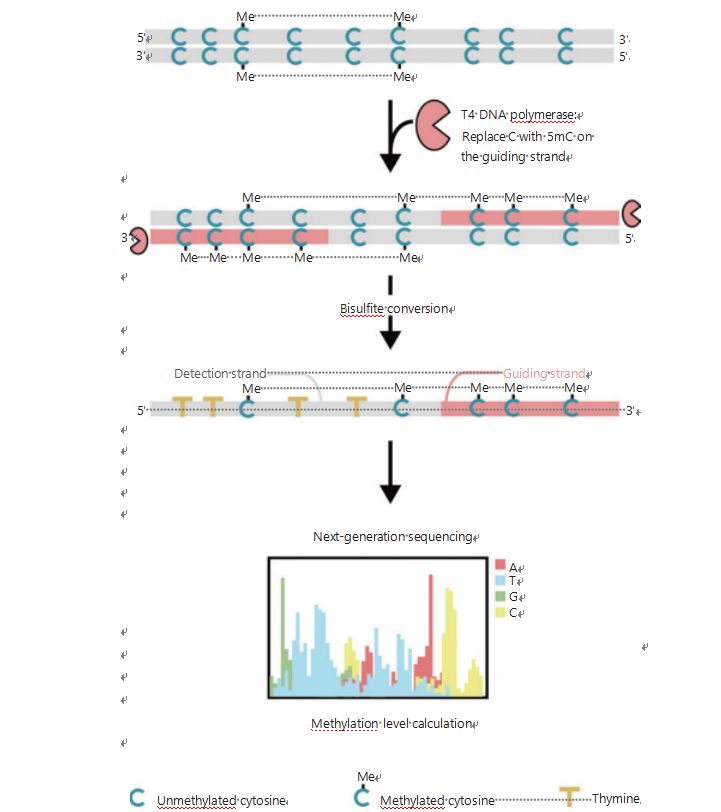
Rakkude epigeneetiliste mustrite paremaks uurimiseks tuumorigeneesi ja metastaaside ajal töötasime välja ainulaadse GPS-i kogu genoomi hõlmava DNA metüülimise tuvastamiseks, mis katab kuni 96% CpG saitidest 0, 4 miljardi lugemise korral25.GPS on kahepoolne sekveneerimismeetod, mis kasutab pärast bisulfitiga töötlemist mittekonverteeritavate metüültsütosiinide DNA fragmendi 3'-otsa, mis juhib 5'-otsa DNA metüülimise arvutamise joondamist läbi paariotsa sekveneerimise (joonis 1)25.Metüültsütosiini juhtahel, mis toimib malliahelana, aitab kaasa kõrge GC piirkonna joondamisele, mis taastab traditsioonilise WGBS-i kõige mahajäetud sekveneerimisandmed.GPS-i kõrge katvuse funktsioon pakub tohutul hulgal DNA metüülimise teavet, mis võimaldab meil uurida vähi metüülimise profiile märkimisväärselt kõrgema eraldusvõimega varem vähe uuritud piirkondades.
GPS pakub meile võimsa tööriista vähi homogeensuse uurimiseks, mis võib oluliselt lihtsustada vähiuuringuid ja potentsiaalselt leida universaalse seletuse tuumorigeneesile ja metastaasidele.Vähirakuliinide GPS-andmete analüüsimisel ilmnes sageli unikaalne nähtus.Paljud piirkonnad tundusid olevat ebanormaalselt hüpermetüleeritud mitut tüüpi vähiproovides.See ootamatu leid kinnitati hiljem UCOM-idena.The Cancer Genome Atlas (TCGA) andmebaasis on analüüsitud rohkem kui 7000 proovi 17 vähitüübist, mille hulgas tuvastasime esimese UCOM, HIST1H4F, histooniga seotud geeni, mis on hüpermetüleeritud kõigi vähitüüpide korral27.Seejärel leiti ja kinnitati TCGA andmebaasis, Gene Expression Omnibus (GEO) andmebaasis ja reaalsetes kliinilistes proovides rida UCOM-e.Praeguse seisuga on leitud ja kinnitatud UCOM-idena HIST1H4F, PCDHGB7 ja SIX6.UCOM-ide ootamatu avastamine pakub võimsa vastuse vähi varajase avastamise vajadusele.UCOM-id pakuvad lahendust mitme vähi ühe markeri tuvastamiseks.
UCOM-ide omadused
Valideerimisel on näidatud, et UCOM-idel on neli peamist omadust, mis võimaldavad UCOM-idel ületada praeguste biomarkerite efektiivsust (joonis 2).
Ainulaadne pahaloomuliste kasvajate puhul
UCOM-id on ainulaadsed vähktõve või vähieelsete kahjustuste puhul ja normaalsed füsioloogilised muutused neid ei mõjuta.Mõned praegused vähiga seotud markerid, mida on laialdaselt kasutatud varajasel avastamisel ja/või sõeluuringul, on viinud ülediagnoosimiseni.Kõrgenenud PSA tase, mis on kliiniliselt akrediteeritud sõeluuringu vahend, tuvastatakse ka healoomuliste seisundite korral, nagu eesnäärme hüperplaasia ja prostatiit10.Ülediagnoosimine ja sellest tulenev üleravi põhjustab soolestiku, kuseteede ja seksuaalsete tüsistuste tõttu elukvaliteedi langust28.Teised valgupõhised ja kliinilises keskkonnas laialdaselt kasutatavad biomarkerid, nagu CA-125, ei ole ülediagnoosimise ja üleravi korral märkimisväärset kasu toonud29.UCOM-ide kõrge spetsiifilisus pahaloomuliste kasvajate suhtes väldib neid puudusi.UCOM, PCDHGB7, eristab tõhusalt kõrge astme lamerakujulisi intraepiteliaalseid kahjustusi (HSIL) ja emakakaelavähki normaalsetest proovidest ja madala astme lamerakujulistest intraepiteliaalsetest kahjustustest (LSIL), samas kui enamik teisi biomarkereid suudavad eristada emakakaelavähki ainult tavalistest proovidest30.Kuigi PCDHGB7 ei tuvasta olulisi erinevusi normaalse endomeetriumi ja endomeetriumi hüperplaasia vahel, tuvastatakse olulised erinevused normaalse endomeetriumi ja atüüpilise hüperplaasia vahel ning PCDHGB731 põhjal tuvastatakse normaalse endomeetriumi ja endomeetriumi vähi (EC) vahel veelgi suuremad erinevused.UCOM-id on unikaalsed pahaloomuliste kahjustuste jaoks andmebaasides ja kliinilistes proovides.Patsiendi vaatenurgast vähendavad ainulaadsed UCOM-id erinevate halvasti toimivate ebastabiilsete biomarkerite keeruliste näidustuste ja vastava ärevuse mõistmise künnist hindamisprotsessi ajal.Arsti vaatenurgast eristavad ainulaadsed UCOM-id pahaloomulisi kasvajaid healoomulistest kahjustustest, mis aitab patsiente eristada ning vähendab tarbetuid meditsiinilisi protseduure ja üleravi.Seetõttu vähendavad ainulaadsed UCOM-id meditsiinisüsteemi liiasust, leevendavad süsteemi häireid ja teevad abivajajatele kättesaadavaks rohkem meditsiinilisi ressursse.
Joonis 1 GPS-i töövoo skeem DNA metüülimise tuvastamiseks25.Hall joon: sisend DNA järjestus;punane joon: DNA töödeldud T4 DNA polümeraasiga, asendades tsütosiini 5'-metüültsütosiiniga sisendi 3' otsas;sinine C koos Me-ga: metüülitud tsütosiin;sinine C: metüleerimata tsütosiin;kollane T: tümiin25.
Kõik või mitte midagi
UCOM-id esinevad ainult vähirakkudes ja neid tuvastatakse stabiilselt peaaegu kõigis vähirakkudes.HIST1H4F oli hüpermetüleeritud peaaegu kõigis kasvajatüüpides, kuid mitte normaalsetes proovides27.Samamoodi on näidatud, et PCDHGB7 ja SIX6 on hüpermetüleeritud kõigis kasvajaproovides, kuid mitte normaalsetes proovides30-32.See ainulaadne omadus parandab oluliselt UCOM-ide jõudlust tuvastamis- ja tundlikkuspiiri suhtes.Proovides saab diferentseerida vaid 2% vähirakkudest, mistõttu UCOM-id on palju tundlikumad biomarkerid kui enamik olemasolevaid biomarkereid30. Kolorektaalse vähi tuvastamiseks kasutatava biomarkerina esinevad KRAS-i mutatsioonid vaid ligikaudu 36% kolorektaalse vähi juhtudest. mis viitab halvale diagnostilisele potentsiaalile33.KRAS-i mutatsioonide madal levimus kolorektaalvähi korral piirab KRAS-i kombinatsioonis teiste biomarkeritega.Tegelikult võib biomarkerite kombinatsioon esialgu tunduda paljutõotav, kuid see ei anna alati rahuldavat tulemust, näidates samas tuvastamisanalüüsis palju suuremat müra ja hõlmab tavaliselt keerukamaid katseprotseduure.Seevastu PCDHGB7 ja muud UCOM-id eksisteerivad kõigis vähivormides.UCOM-id tuvastavad vähkkasvajaid eri tüüpi vähiproovides ülima täpsusega, kõrvaldades samal ajal keerukad mürasummutavad analüüsiprotsessid.Vähktõbe ei ole raske avastada rohkest proovist, kuid väikesest proovist on vähktõve tuvastamine äärmiselt keeruline.UCOM-id on võimelised tuvastama väikeses koguses vähki.
Joonis 2 UCOM-ide omadused.
Vähi avastamine enne patoloogilisi muutusi
UCOM-i saab tuvastada vähieelses staadiumis enne patoloogilisi muutusi.Epigeneetiliste biomarkeritena esinevad UCOM-i kõrvalekalded varasemas staadiumis kui fenotüübilised kõrvalekalded ja need on tuvastatavad kogu tuumorigeneesi, progresseerumise ja metastaaside ajal34, 35.UCOM-i tundlikkus aja jooksul suurendab UCOM-i jõudlust varajases staadiumis vähi ja vähieelsete kahjustuste avastamisel.Varajase vähi tuvastamine biopsiate ja tsütoloogia põhjal võib olla keeruline isegi kõige kogenumatele patoloogidele.Üks kolposkoopiaga saadud biopsia on olnud positiivne 60,6% HSIL+ proovidest.Tundlikkuse suurendamiseks on vaja mitme kahjustuse korral võtta täiendavaid biopsiaid36.Seevastu UCOM-i PCDHGB7 tundlikkus on HSIL+ proovide suhtes 82%, mis ületab biopsiate ja enamiku biomarkerite tundlikkust30.Metülatsioonimarkeri FAM19A4 tundlikkus CIN2+ suhtes on 69%, mis on sarnane tsütoloogiaga, kuid ei erista CIN1 tavalistest proovidest37.On näidatud, et UCOM-id on palju tundlikum varajase avastamise biomarker.Võrreldes kogemuspõhiste patoloogidega on UCOM-idel parem avastamistundlikkus varajases staadiumis vähkkasvajate suhtes, mis omakorda aitab kaasa vähiprognoosi ja ellujäämise paranemisele30.Lisaks pakuvad UCOM-id avastamisplatvormi, mis on juurdepääsetav piirkondadele, kus puuduvad kogenud patoloogid, ja mis parandab oluliselt tuvastamise tõhusust.Ühtsete proovivõtu- ja tuvastamisprotseduuridega annab UCOM-i tuvastamine stabiilsed ja kergesti tõlgendatavad tulemused, mis sobivad paremini skriininguprotokolliga, mis nõuab vähem professionaalset personali ja meditsiinilisi ressursse.
Lihtne tuvastada
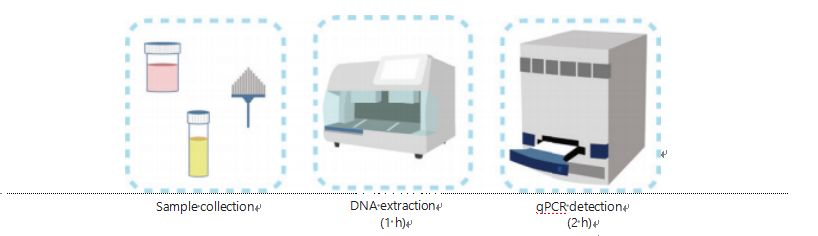
Praegused meetodid DNA metüülimise tuvastamiseks on keerulised ja aeganõudvad.Enamik meetodeid nõuab vesiniksulfiidi muundamist, mis põhjustab proovi kvaliteedi kadu ja võib anda ebastabiilseid ja ebatäpseid tulemusi.Bisulfitravi põhjustatud halb reprodutseeritavus võib põhjustada arstide ja patsientide segadust ning segada veelgi järelkontrolli ja/või ravistrateegiaid.Seetõttu muutsime veelgi UCOM-i tuvastamise meetodit, et vältida proovide probleemset bisulfittöötlust, kohandada kliinilise rakenduse nõudeid ja parandada juurdepääsetavust.Töötasime välja uudse meetodi, milles kasutati metüülimise suhtes tundlikke restriktsiooniensüüme kombineerituna reaalajas fluorestsents-kvantitatiivse PCR-iga (Me-qPCR), et kvantifitseerida UCOM-ide metüülimise olek 3 tunni jooksul, kasutades lihtsaid käsitsemisprotseduure (joonis 3).Me-qPCR mahutab mitut tüüpi proovi, nagu kehavedelike kliiniline kogumine ja ise kogutud uriiniproovid.Kogutud kliinilisi proove saab töödelda, säilitada ja hõlpsasti tuvastada, kasutades standardiseeritud ja automatiseeritud DNA ekstraheerimist.Ekstraheeritud DNA saab seejärel ühe poti reaktsiooni ja väljundi kvantifitseerimise tulemuste saamiseks otse rakendada Me-qPCR platvormile.Pärast lihtsat tulemuste analüüsi, kasutades konkreetsetele vähitüüpidele kohandatud ja valideeritud diagnostilisi mudeleid, tõlgendatakse UCOM-i tuvastamise tulemuste lõplik määramine ja esitatakse poolkvantitatiivse väärtusena.EZ DNA Methylation-Gold komplekti protokolli kohaselt ületab Me-qPCR platvorm UCOM-i tuvastamisel traditsioonilist bisulfitpürosekveneerimist, säästes samal ajal 3 tundi bisulfiti muundamisest.Uuenduslik metüülimise tuvastamise platvorm muudab UCOM-i tuvastamise stabiilsemaks, täpsemaks ja juurdepääsetavamaks30.
Joonis 3 UCOMide tuvastamise protsess.Proovitüübid hõlmavad professionaalselt võetud BALF-i, Pap-harja ja/või ise kogutud uriiniproove.DNA ekstraheerimisprotsessi saab paigutada automaatsele ekstraktorile, mille produkti saab qPCR abil otse tuvastada.
UCOM-ide rakendamine
Kopsuvähk
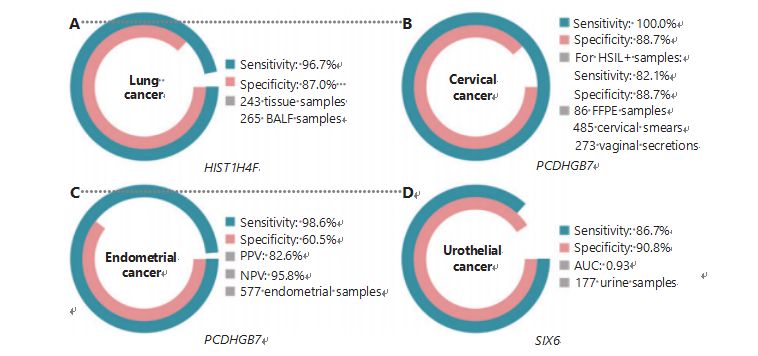
Kopsuvähk on maailmas kõige sagedamini diagnoositud ja kõige surmavam vähk, mis moodustab 11,4% uutest juhtudest ja 18,0% uutest surmajuhtumitest1.Kõigist diagnoosidest on 85% mitteväikerakk-kopsuvähk (NSCLC) ja 15% väikerakk-kopsuvähk (SCLC), millel on kõrgem pahaloomuliste kasvajate tase38.Väikese doosiga kompuutertomograafia (LDCT) skaneerimine on praegu soovitatav kopsuvähi sõeluuringumeetod ning see parandab varajast avastamist ja vähendab suremust6;Kuid madala spetsiifilisuse ja halva juurdepääsetavuse tõttu ei ole LDCT veel rahuldav sõeluuringumeetod, nagu ka teised tavalised vähimarkerid, nagu CEA39.LDCT sõeluuringu strateegia kulud ja võimalikud vastamata diagnoosid ja valediagnoosid takistavad kopsuvähi sõeluuringu edendamise edenemist40.HIST1H4F, UCOM, omab tohutut potentsiaali varajase avastamise biomarkerina bronhoalveolaarse vedeliku (BALF) proovides27.HIST1H4F on hüpermetüleeritud kopsu adenokartsinoomi ja kopsu lamerakulise kartsinoomi korral, tuvastamise spetsiifilisus 96, 7% ja tundlikkus 87, 0% (joonis 4A) ning erakordne jõudlus I staadiumi vähi korral27.HIST1H4F spetsiifilisus on NSCLC puhul 96,5% ja tundlikkus 85,4% ning SCLC27 puhul vastavalt 96,5% ja 95,7%.Lisaks on kaheksa teist tüüpi vähi, sealhulgas kõhunäärme- ja kolorektaalse vähi proovid kinnitanud, et HIST1H4F on kõigis kaheksas tüübis hüpermetüleeritud27.
Emakakaelavähk
Emakakaelavähk oli 2020. aastal neljas kõige sagedamini diagnoositud vähk ja neljas peamine vähisurmade põhjus naistel, moodustades 3,1% uutest juhtudest ja 3,4% vähiga seotud surmajuhtumitest kogu maailmas1.Emakakaelavähi likvideerimiseks aastaks 2030, nagu WHO on soovitanud, on emakakaelavähi varajane avastamine hädavajalik.Varases staadiumis avastamise korral ulatub 5-aastane elulemus invasiivse emakakaelavähi korral 92%-ni41.Ameerika Vähiliidu (ACS) juhised soovitavad teha emakakaela tsütoloogiateste, primaarseid HPV teste või sõeluuringuid42.Emakakaela tsütoloogia on invasiivne ja suudab tuvastada ainult 63,5% CIN2+ juhtudest37.
Seevastu PCDHGB7 on Pap-määrde ja tupesekreedi kasutamisel palju paremini toiminud ning suudab HSIL-i LSIL-i väga varajases staadiumis tõhusalt eristada.Ainuüksi PCDHGB7 tundlikkus on emakakaelavähi puhul 100,0% ja spetsiifilisus 88,7% (joonis 4B) ning HSIL+ proovide puhul 82,1% tundlikkus ja 88,7% spetsiifilisus30.PCDHGB7 tundlikkus on 90,9% ja spetsiifilisus 90,4% emakakaelavähi tupesekreedi proovides, mida on palju lihtsam koguda30.Kombineerituna kõrge riskiga (hr)HPV testiga või Thinprep tsütoloogiatestiga (TCT), on PCDHGB7 tundlikkus suurenenud 95,7% ja spetsiifilisus 96,2%, mis ületab oluliselt hrHPV testi (20,3%) ja TCT (51,2%) oma. ) ja need kaks kokku (57,8%) emakakaelavähi puhul30.Samuti on näidatud, et PCDHGB7 on TCGA andmebaasist hüpermetüleeritud 17 vähitüübi puhul, mis näitab selle sobivust UCOM-i perekonda30.
Joonis 4 UCOM-id on suuremahulistes kliinilistes uuringutes valideeritud nelja vähitüübi puhul.A. UCOM-i HIST1H4F toimivus kopsuvähi tuvastamisel 508 proovist.B. UCOM-i PCDHGB7 toimivus emakakaelavähi tuvastamisel 844 proovist.C. UCOM-i PCDHGB7 toimivus endomeetriumi vähi tuvastamisel 577 endomeetriumi Pap- ja Tao pintsli proovis.D. UCOM-i SIX6 toimivus uroteelivähi tuvastamisel 177 proovist.
EC
EC on üks levinumaid naiste reproduktiivsüsteemi vähktõbesid kogu maailmas, hinnanguliselt 4,2 miljonit uut juhtumit ja 1% vähiga seotud surmajuhtumitest aastas1.Eduka diagnoosiga varases staadiumis on EK ravitav ja I staadiumi vähi 5-aastane elulemus on 95%.Patsiendid, kellel on sümptomid, nagu ebanormaalne emakaverejooks, saavad perioodilist kliinilist hindamist ning neile tehakse invasiivsed ja valulikud biopsiaprotseduurid, hoolimata sellest, et lõpuks tekib EC43 ainult 5–10%.Transvaginaalne ultraheli kui tavaline tuvastamismeetod on väga ebausaldusväärne, kuna see ei suuda eristada healoomulisi endomeetriumi muutusi pahaloomulistest ja valepositiivsete tulemuste kõrge määr44.
Viidi läbi paralleelselt seerumi CA-125, laialdaselt juurutatud EÜ biomarkeri ja PCDHGB7 võrdlus.Seerumi CA-125 tundlikkus oli 24,8%, mis viitab sellele, et CA-125 on EC jaoks ebapiisav marker, hoolimata 92,3% spetsiifilisusest31.PCDHGB7 tuvastamine Pap-harja proovide abil andis ECatalli etappide jaoks tundlikkuseks 80,65% ja spetsiifilisuseks 82,81%, samas kui Tao harja tundlikkus oli 61,29% ja spetsiifilisus 95,31%31.Me-qPCR-il põhinev PCDHGB7 diagnostikamudel andis Pap- ja Tao pintsliproove kasutades tundlikkuseks 98,61%, spetsiifilisuseks 60,5% ja üldiseks täpsuseks 85,5% (joonis 4C)31.
Uroteeli vähk
Uroteelvähk, mis koosneb põie-, neeruvaagna- ja kusejuhavähistest, oli 2020. aastal maailmas seitsmendal kohal kõige sagedamini diagnoositud vähist, põhjustades 5,2% uutest juhtudest ja 3,9% surmajuhtumitest1.Uroteelivähid, millest enam kui 50% on põievähk, olid 2022. aastal USA-s kõige sagedamini diagnoositud vähivormid neljandal kohal, moodustades 11,6% uutest diagnoositud juhtudest3.Ligikaudu 75% põievähkidest klassifitseeritakse mitte-lihasesse invasiivseks põievähiks, mis piirdub limaskesta või submukoosaga45.Tsüstoskoopia biopsia on uroteelivähi diagnoosimise kuldstandard, mida rakendatakse fluorestsents in situ hübridisatsiooni (FISH) ja tsütoloogiliste testide abil.FISH-il ja tsütoloogial on halb diagnostiline jõudlus ning tsüstoskoopia on pealetükkiv ning sellel on oht mikrolesioonide puudumiseks, kahjustuste valesti tõlgendamiseks ja potentsiaalseks vähi levikuks või retsidiiviks46.Varem valideeritud UCOM PCDHGB7 oli samuti hüpermetüleeritud uroteelivähi korral, kõvera alune pindala oli 0, 86, mis viitab potentsiaalsele diagnoosimisvõimele30.Rohkemate UCOM-ide edasiseks valideerimiseks ja rohkemate proovitüüpide paremaks kohandamiseks uuriti uudset UCOM-i SIX6, mis näitas suurepärast diagnostilist potentsiaali uroteelivähi varajasel avastamisel, kasutades uriiniproove Me-qPCR platvormil.SIX6 tuvastamine uriiniproovidega näitas konkurentsitundlikkust 86,7% ja spetsiifilisust 90,8% (joonis 4D), olles samas mitteinvasiivne ja kergesti omandatav32.Praegu uuritakse SIX6 potentsiaali metastaaside jälgimisel ja ravi efektiivsuse hindamisel.
Tulevik ja väljakutsed
UCOM-idel on mitme vähi diagnostilise potentsiaali osas tugev jõudlus, kuid teha on veel palju tööd.Oleme UCOM-ide loendit laiendanud ja aktiivselt valideerinud UCOM-e rohkemate vähitüüpide puhul, sealhulgas nende puhul, mida on traditsiooniliselt raske avastada.TCGA andmebaasidest saadud valideerimistulemused on veelgi kinnitanud UCOM-ide rakendamist rohkemate vähitüüpide ja olukordade puhul.Esialgse uurimise käigus on näidatud, et UCOM-idel on tugev kolangiokartsinoomide ja pankrease adenokartsinoomide diagnostiline potentsiaal, mida on praeguste sõeluuringute meetoditega peaaegu võimatu diagnoosida varases staadiumis32, 47.Võimet tuvastada haruldasi vähkkasvajaid UCOM-idega saab kasutada tsirkuleeriva kasvaja DNA-ga (ctDNA) täiustatud vedela biopsia platvormi abil48.Plasma DNA-l põhineva pan-vähi tuvastamise paneeli hõlmav uuring andis tundlikkuseks 57,9%49.Vaatamata kõrgele spetsiifilisusele näitab üldine jõudlus, et arenguruumi on veel.
UCOM-ide ainulaadsed omadused on toetanud ka UCOM-i potentsiaali uurimist ravi efektiivsuse hindamisel ja kordumise jälgimisel.Tahkete kasvajate ravivastuse hindamiskriteeriumide (RECIST) kohaselt on meditsiiniline kuvamine soovitatav metoodika kordumise jälgimiseks ja ravi efektiivsuse hindamiseks, samas kui hindamiseks kasutatakse ainult kasvajamarkereid50.Tegelikkuses mõjutavad pildistamise lähenemisviisid aga suuresti sagedus ja ajastus ning seetõttu seavad patsiendid suurema riski ja kulud51,52.SIX6 on kinnitatud rinnavähi metastaaside ennustajana32.Vedelbiopsial põhinev ctDNA seire võimaldab reaalajas jälgida minimaalse jääkhaiguse kuu jooksul enne radioloogilist avastamist, ideaaljuhul aeglustades ja ennetades retsidiiviga seotud vähi progresseerumist53.Esialgsed tulemused näitavad, et UCOM-id peegeldavad vähi hüpermetüleerimise taset reaalajas kohe pärast operatsiooni ja ravi32.UCOM-ide kõrge tundlikkus ja rakendatavus mitmes mittesissetungivas proovitüübis võimaldavad UCOMidel toimida täpse kordumise jälgimise biomarkerina, säilitades samal ajal patsiendi kõrge ravisoostumuse.
Samal ajal on avalik juurdepääs testile veel üks suur probleem, mis nõuab täiendavaid jõupingutusi.Kuigi UCOM-i tuvastamise koostöö on kasutusele võetud rohkemates haiglates, lootuses tuua kasu rohkematele patsientidele, on Hiina maapiirkondades aktiivselt tehtud pro bono tuvastamisi ja sõeluuringuid.UCOM-id vajavad paremat juurdepääsetavust, et kvalifitseeruda teostatavaks sõelumisvahendiks, eriti vähearenenud piirkondade jaoks.
Kuigi UCOM-i rakenduse tulemused varajasel tuvastamisel on paljulubavad, on UCOM-i kohta palju tundmatut.Aktiivse uurimisega on õigustatud täiendavad uuringud selle kohta, miks UCOM-id vähivormides üldiselt esinevad.UCOM-ide aluseks olevad epigeneetilised regulatsioonimehhanismid väärivad täiendavat uurimist, mis võib õigustada vähiravi uut suunda.Tulles tagasi kasvaja homogeensuse ja heterogeensuse vastastikuse mõju juurde, huvitab meid, miks UCOM-id võivad olla erand enamikust vähi biomarkeritest, mis on tihedalt seotud konkreetsete vähitüüpidega.UCOM-i tuvastatud DNA metüülimise aberratsioonide rolli tuumorigeneesis, kasvaja progresseerumises ja metastaasides ei ole kindlaks tehtud raku identiteedi kaotamise ja taastamise protsessis ning see nõuab põhjalikku kontrolli.Teine suur huvi seisneb UCOM-ide homogeensuse tunnuse kaasamises koe ainulaadsete markeritega, lootes läheneda vähijälgede täpsele tuvastamisele ja kasvajakoe päritolu tuvastamisele vastupidisel viisil.UCOM-id võivad olla ideaalne vahend vähi ennetamiseks, vähi tuvastamiseks ning potentsiaalselt vähi kaitsmiseks ja kõrvaldamiseks.
Toetuse andmine
Seda tööd toetasid Hiina riiklik teadus- ja arendustegevuse põhiprogramm (grandi nr 2022BEG01003), Hiina riiklik loodusteaduste sihtasutus (toetus nr 32270645 ja 32000505), Heilongjiangi provintsi tervisekomisjoni toetus (toetus nr 2020-111) ja Heze teadus- ja tehnoloogiainstituudi stipendium (grandi nr 2021KJPT07).
Huvide konflikti avaldus
Wei Li on Shanghai Epiprobe Biotechnology Co., Ltd. teadus- ja arendusdirektor. Wenqiang Yu töötab Epiprobe'i teaduslikus nõuandekogus.W. Yu ja Epiprobe on heaks kiitnud selle tööga seotud menetluses olevad patendid.Kõik teised autorid ei deklareeri konkureerivaid huve.
Autorite kaastööd
Projekti kavandas ja kujundas: Chengchen Qian ja Wenqiang Yu.
Kirjutas referaadi: Chengchen Qian.
Illustratsioonid on teinud: Chengchen Qian.
Käsikirja üle vaadanud ja toimetanud: Xiaolong Zou, Wei Li, Yinshan Li ja Wenqiang Yu.
Viited
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A jt.Ülemaailmne vähistatistika 2020: GLOBOCANi hinnangud
esinemissagedus ja suremus kogu maailmas 36 vähi puhul 185 riigis.CA Cancer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S jt.Vähistatistika Hiinas ja Ameerika Ühendriikides, 2022: profiilid, suundumused ja määrajad.Chin MedJ (inglise keel).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Vähistatistika, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M jt.Vähi varajane avastamine.Teadus.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Strateegiad
kolorektaalse vähi sõeluuring.Gastroenteroloogia.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Kopsuvähi sõeluuring.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P jt.IARC vaatenurk emakakaelavähi sõeluuringule.N InglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Kolposkoopia väljakutsed emakakaelavähi sõeluuringuks LMIC-des ja tehisintellekti lahendused.BMC Med.2020;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Tsirkuleerivad biomarkerid hepatotsellulaarse kartsinoomi diagnoosimisel ja ravil.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Seerumi PSA-põhine eesnäärmevähi varajane avastamine Euroopas ja globaalselt: minevik, olevik ja tulevik.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, parim T, Watanabe J, KajitaY,
et al.Multipleksse RNA uriinitesti väljatöötamine põie üleminekurakulise kartsinoomi tuvastamiseks ja kihistamiseks.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hüpometüleerimine eristab mõnede inimese vähivormide geene nende tavalistest analoogidest.Loodus.1983;301: 89-92.
13. Ng JM, Yu J. Promoter hypermethylation of kasvaja supressor geenid kui potentsiaalsed biomarkerid kolorektaalse vähi korral.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Vähi epigenoomika: DNA metüloomid ja histooni modifikatsiooni kaardid.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigeerimine vähi DNA metüülimise maastikul.Trends Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P jt.Inimese embrüonaalsete tüvirakkude mitmeliinilise diferentseerumise epigenoomne analüüs.Kamber.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X jt.Kogu genoomi hõlmavad analüüsid näitavad Polycombi rolli DNA metülatsiooniorgude hüpometüleerimise soodustamisel.Genome Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et al.DNA metüülimise analüüs vähi korral: asukoht on uuesti läbi vaadatud.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D jt.Sihtotstarbelise metüülimisel põhineva mitme vähi varajase avastamise testi kliiniline valideerimine, kasutades sõltumatut valideerimiskomplekti.Ann Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.Vähi tunnused.Kamber.2000;100:57-70.
21. Hanahan D. Vähi tunnused: uued mõõtmed.Cancer Discov.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Täppis onkoloogia: kes, kuidas, mida, millal ja millal mitte?Am Soc Clin Oncol Haridusraamat.2017: 160-9.
23. Liu H, Meng X, Wang J. Reaalajas kvantitatiivne metüülimine
PAX1 geeni tuvastamine emakakaelavähi sõeluuringus.IntJ günekoolvähk.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP jt.Multitargetstool DNA testimine kolorektaalvähi sõeluuringuks.N InglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S jt.Juhise positsioneerimine
sekveneerimine tuvastab ebanormaalsed DNA metüülimismustrid, mis muudavad raku identiteeti ja kasvaja-immuunse seirevõrke.Genoom
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY jt.Mittepeale tungiv mitme vähi tuvastamine tsirkuleeriva rakuvaba DNA metüülimise sekveneerimise (THUNDER) abil: arendus- ja sõltumatud valideerimisuuringud.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B jt.Histooniga seotud geenid on kopsuvähi korral hüpermetüleeritud ja hüpermetüleeritud
HIST1H4F võiks olla pan vähi biomarker.Cancer Res.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V jt.Eesnäärmespetsiifilise antigeeni sõeluuringu mõju elukvaliteedile.N InglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Clinical Efektness of cancer skriining biomarker tests offer as self-pay health service: a systematic review.Eur J Rahvatervis.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z jt.
Hüpermetüleeritud PCDHGB7 kui universaalne ainult vähimarker ja selle rakendamine varajases emakakaelavähi sõeluuringus.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X jt.Hüpermetüleeritud PCDHGB7 biomarkerina endomeetriumi vähi varaseks avastamiseks endomeetriumi harja proovides ja emakakaela kraapides.Esiosa Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F jt.Vastastikku
eksklusiivne epigeneetiline modifikatsioon SIX6-l koos hüpermetüleerimisega vähieelse staadiumi ja metastaaside tekke jälgimiseks.Signal Transduct Target Ther.2022;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS-i mutatsioon: vähi puhul ravikõlbmatust ravikõlblikuks.Signal Transduct Target Ther.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE jt.P16 (INK4a) ebanormaalne metüülimine on kopsuvähi varajane sündmus ja potentsiaalne biomarker varaseks diagnoosimiseks.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.DNA metüülimine ja inimese haigus.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C et al.Mitu biopsiat ja emakakaelavähi prekursorite tuvastamine kolposkoopias.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD et al.FAM19A4 metüülimise analüüs
geen emakakaela kriimustustes on emakakaela tuvastamisel väga tõhus
kartsinoomid ja kaugelearenenud CIN2/3 kahjustused.Cancer Prev Res (Phila).2014;7: 1251-1257.
38. Tai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Kopsuvähk.Lancet.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Kartsinoembrüonaalne antigeen (CEA) kui kasvaja marker kopsuvähi korral.Kopsuvähk.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L jt.Kopsuvähi sõeluuring, versioon 3.2018, NCCN kliinilise praktika juhised onkoloogias.J Natl Compr Canc Netw.2018;16: 412-41.
41. Ameerika Vähiliit.Vähi faktid ja arvud.Atlanta, GA, USA: Ameerika Vähiliit;2023 [uuendatud 2023. aasta 1. märtsil;viidatud 2023. aasta 22. august].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A et al.Emakakaelavähi sõeluuringud keskmise riskiga inimestele: Ameerika Vähiliidu 2020. aasta suuniste värskendus.CA Cancer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Endomeetriumi vähi riski seos menopausijärgse verejooksuga naistel: süstemaatiline ülevaade ja metaanalüüs.JAMA intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A et al.Transvaginaalse ultraheliuuringu tundlikkus
endomeetriumi vähi puhul menopausijärgses eas naistel: juhtumikontrolli uuring UKCTOCSi kohordis.Lancet Oncol.2011;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ et al.Euroopa Uroloogide Assotsiatsiooni juhised mittelihaseinvasiivse põievähi kohta (TaT1 ja kartsinoom in situ) –
2019. aasta värskendus.Eur Urol.2019;76: 639-57.
46. Aragon-Ching JB.Uroteeli ülatrakti ja põie kartsinoomide diagnoosimise, bioloogia ja ravi väljakutsed ja edusammud.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Kolangiokartsinoom – arenevad mõisted ja ravistrateegiad.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Vedelbiopsia hepatotsellulaarses
kartsinoom: ringlevad kasvajarakud ja ringleva kasvaja DNA.Mol Vähk.2019;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K jt.Pan-vähk
ringleva kasvaja DNA tuvastamine enam kui 10 000 Hiina patsiendil.Nat Commun.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R jt.Uued ravivastuse hindamiskriteeriumid soliidtuumorite puhul: muudetud RECISTi juhis (versioon 1.1).Eur J Vähk.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST – minevikust õppimine tuleviku ehitamiseks.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S jt.iRECIST: juhised uuringutes kasutatavate reaktsioonikriteeriumide kohta
immunoterapeutiliste ravimite testimine.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Vedelikbiopsia ja minimaalne jääkhaigus – viimased edusammud ja tagajärjed ravile.Nat Rev Clin Oncol.2019;16: 409-24.
Tsiteeri seda artiklit järgmiselt: Qian C, Zou X, Li W, Li Y, Yu W. Vähktõve eelpost: universaalsed ainult vähimarkerid.Cancer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Postitusaeg: mai-07-2024